Nano Lett. |
您所在的位置:网站首页 › 特洛伊 木马 › Nano Lett. |
Nano Lett.
|
Nano Lett. | 失活特洛伊木马细菌作为安全的药物输送载体穿越血脑屏障
英文原题:Inactive Trojan Bacteria as Safe Drug Delivery Vehicles Crossing the Blood–Brain Barrier
通讯作者:宋斌,王后禹,何耀;单位:苏州大学 作者:Jianping Lu(陆剑萍), Jiali Ding(丁嘉丽), Binbin Chu(储彬彬), Chen Ji(季晨), Qian Zhang(张倩), Yanan Xu(徐亚楠), Bin Song(宋斌), Houyu Wang(王后禹), Yao He(何耀) 背景介绍 血脑屏障(Blood-Brain-Barrier, BBB)是人类和其他动物脑组织中特化的屏障结构,它将中枢神经系统(Central Nervous System, CNS)与外周血液循环分开,可以保证大脑不受外周系统变化的影响,对于维持动物中枢神经系统内环境稳态及功能正常具有极其重要的意义。血脑屏障复杂的细胞相互作用维持了其完整性并限制了药物的渗透,导致中枢神经系统疾病治疗剂研发的成功率比较低。因此,开发治疗中枢神经系统疾病的药物的最大挑战之一是实现足够的血脑屏障渗透。由于细菌能够靶向肿瘤,已经被广泛用于癌症治疗中,并且开发了许多细菌-纳米混合体系,以更好地应用于疾病的治疗。在很多的研究中已经证明了一些细菌具有穿越血脑屏障的能力,例如:膜炎奈瑟菌、肺炎链球菌、B组链球菌和大肠杆菌。然而,由于其潜在的感染相关毒性,活细菌作为治疗药物的临床开发面临着巨大的障碍。文章亮点 近日,苏州大学功能纳米与软物质研究院宋斌助理研究员、王后禹研究员和何耀教授团队在Nano Letters 上报道了一种可以穿越血脑屏障具有较高安全性的细菌纳米药物载体。选取大肠杆菌K1(Escherichia coli K1, EC-K1)作为穿越血脑屏障的载体,构建了一种无活性特洛伊EC-K1体系,探究了无活性特洛伊EC-K1体系穿越血脑屏障的能力,以及其具有的光热效应实现了对脑膜炎和胶质母细胞瘤小鼠模型的治疗。如图1A所示,将麦芽糊精(Maltodextrin,MD)和吲哚菁绿(Indocyanine Green,ICG)分别通过席夫碱反应和静电吸附负载于荧光硅纳米颗粒(Silicon Nanoparticles, SiNPs)上,合成MD-ICG-SiNPs纳米制剂,MD-ICG-SiNPs能够通过连接的MD与EC-K1表面的ATP结合盒式转运通道(ATP-binding cassette transporter, ABC)的相互作用进入EC-K1内部,构建特洛伊EC-K1。其次,为了使特洛伊EC-K1失去细菌毒性,对其进行紫外照射,构建无活性特洛伊EC-K1体系(图1B)。与活的EC-K1类似,无活性特洛伊EC-K1的外膜蛋白A与脑微血管内皮细胞 (BMECs) 上的gp96蛋白结合,启动肌动蛋白细胞骨架重排,然后触发无活性特洛伊EC-K1内化到BMECs,从而穿过血脑屏障(图1C)。 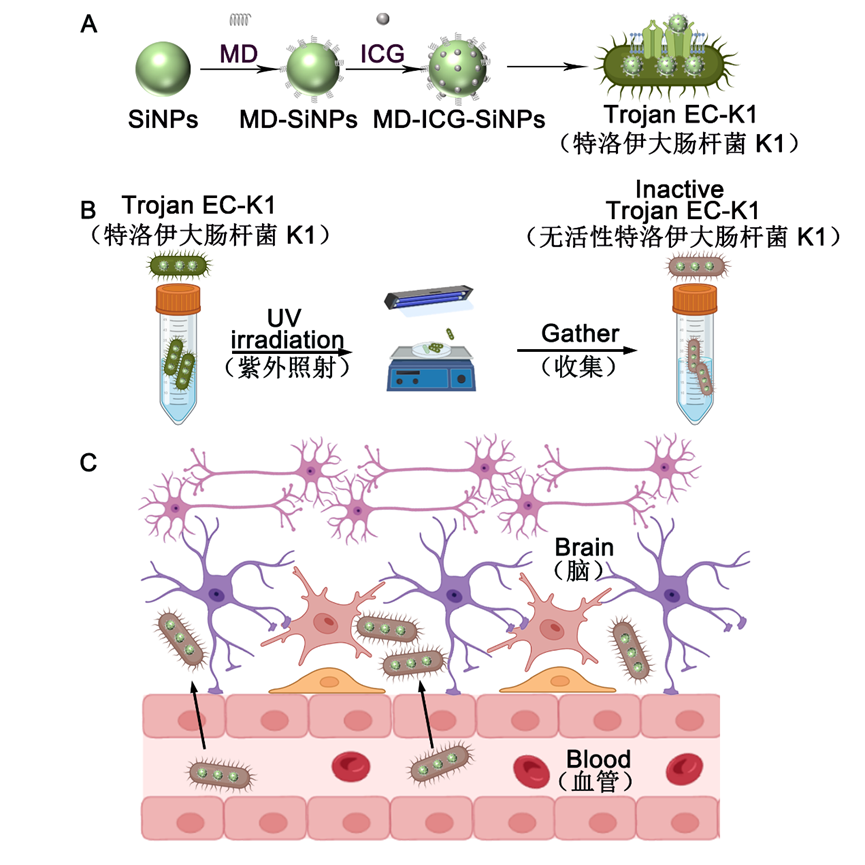 图1.无活性特洛伊大肠杆菌K1药物载体制备方法及穿越血脑屏障示意图, (A)MD-ICG-SiNPs纳米探针的合成步骤及特洛伊大肠杆菌K1体系的构建;(B)在紫外照射下无活性特洛伊大肠杆菌K1体系的构建;(C) 无活性特洛伊大肠杆菌K1体系穿越血脑屏障的示意图。 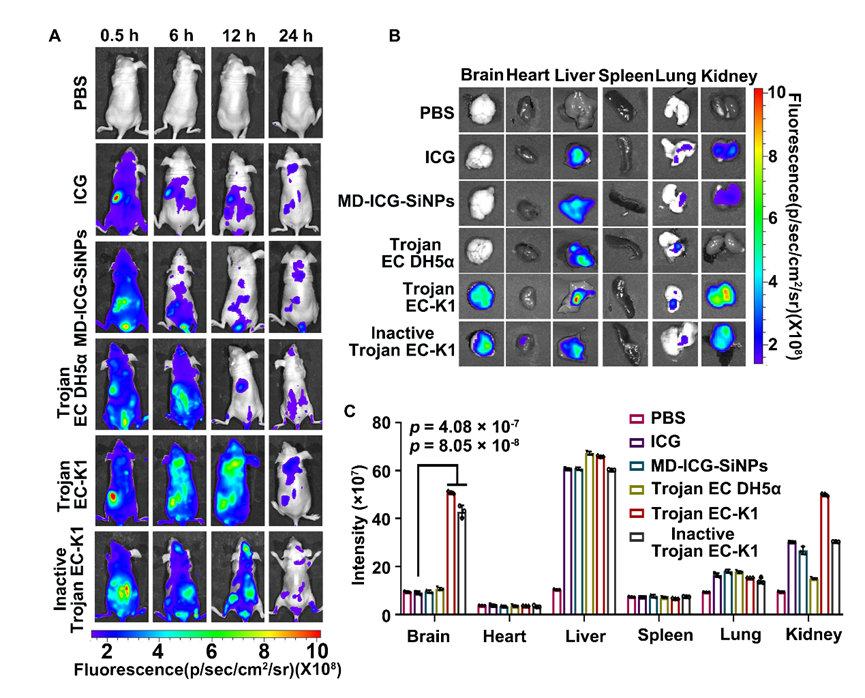 图2(A)小鼠尾静脉注射PBS、ICG、MD-ICG-SiNPs、特洛伊EC DH5α、特洛伊EC-K1、无活性特洛伊EC-K1的代表性体内荧光图像。(B)尾静脉注射后12 h相应组别的小鼠主要器官体外荧光图像(C)相应的荧光强度定量。 如图2A所示,PBS、ICG、MD-ICG-SiNPs、特洛伊大肠杆菌DH5α组别,荧光主要分布在肝脏和肾脏部位,在脑部没有观察到ICG的荧光。相反,在注射后6小时,注射特洛伊EC-K1组和无活性特洛伊EC-K1小鼠的大脑中都出现了明显的ICG的荧光,而它们的荧光强度在注射后12小时达到峰值。之后,在尾静脉注射12小时后进行了脑部的体外成像(图2B)。与注射纯ICG的小鼠相比,注射无活性特洛伊EC-K1的小鼠大脑中的ICG信号大大增强,比纯ICG的信号高3.0倍(图2C),表明无活性木马EC-K1具有良好的脑靶向能力。 总结/展望 本文报道了无活性特洛伊细菌载药体系作为穿越血脑屏障的安全药物输送载体。该体系在有效的血脑屏障穿越后,能够在808 nm激光的照射下,产生光热作用,杀死细菌,实现对脑膜炎和胶质母细胞胶质瘤小鼠的治疗。相关研究为实现跨血脑屏障进行药物递送及中枢神经系统疾病治疗提供了新的思路。 相关论文发表在Nano Letters上,苏州大学功能纳米与软物质研究院硕士生陆剑萍为文章的第一作者,硕士生丁嘉丽为文章的共同第一作者,宋斌助理研究员、王后禹研究员和何耀教授为共同通讯作者。 通讯作者信息:  宋斌 苏州大学 宋斌,助理研究员。主要研究方向为荧光/磷光硅基纳米探针的设计与表征。获江苏省双创博士,主持国家自然科学基金,江苏省自然科学基金等三项。以第一和通讯作者在J. Am. Chem. Soc.、Angew. Chem. Int. Ed、Nano Lett. 等期刊发表论文30余篇,授权国家发明专利3项。 主页:http://funsom.suda.edu.cn/21/9e/c4748a336286/page.htm
王后禹 苏州大学 王后禹,研究员。发展了一系列能够同时实现革兰氏阳性细菌和革兰氏阴性细菌传感、成像分析与治疗的方法。迄今为止,以第一作者或通讯作者身份在Nat. Commun.、J. Am. Chem. Soc.、Angew. Chem. Int. Ed.、Adv. Mater.、Nano Lett.、ACS Nano、Chem. Sci.、Anal. Chem. 等期刊发表论文50余篇,3项国家专利获得授权。 主页:http://funsom.suda.edu.cn/b6/e8/c4746a46824/page.htm  何耀 苏州大学 何耀,教授。研究方向聚焦于发展基于硅基纳米生物成像和传感分析检测技术,为眼部疾病和癌症等重大疾病的精准诊治提供新工具和新方法。已发表包括SCI 学术文章150余篇,SCI论文引用1.2万余次,授权国家专利15项。何耀 教授2012年入选国家科技部“创新人才推进计划”---“中青年科技创新领军人才”;2013年主持“国家重大科学研究计划青年科学家专题项目”;2014年入选国家“万人计划”---“科技创新领军人才”;2017年担任《Frontiers in Chemistry》(nanoscience section)副主编;2017年获“江苏省科学技术奖”一等奖(第一完成人);2018年获国家杰出青年基金资助;2021年担任苏州市纳米技术与生物医药重点实验室主任;2022年获中国青年科技奖。 主页:http://funsom.suda.edu.cn/7f/a3/c2735a32675/page.htm 扫描二维码阅读英文原文,或点此查看原文  Nano Lett. 2023, ASAP Publication Date: May 2, 2023 https://doi.org/10.1021/acs.nanolett.3c00563 Copyright © 2023 American Chemical Society 
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载! 点击分享 收藏 取消收藏 评论: 0 |
【本文地址】
今日新闻 |
推荐新闻 |

